Online first
Bieżący numer
O czasopiśmie
Archiwum
Polityka etyki publikacyjnej
System antyplagiatowy
Instrukcje dla Autorów
Instrukcje dla Recenzentów
Rada Redakcyjna
Bazy indeksacyjne
Komitet Redakcyjny
Recenzenci
2024
2023
2022
2021
2020
2019
2018
Kontakt
Klauzula przetwarzania danych osobowych (RODO)
PRACA ORYGINALNA
Występowanie rtęci w różnych rodzajach miodów
1
Śląski Uniwersytet Medyczny, Polska
Autor do korespondencji
Med Srod. 2020;23(1-4):39-43
SŁOWA KLUCZOWE
DZIEDZINY
STRESZCZENIE
Wprowadzenie i cel pracy:
Medycyna naturalna w obecnych czasach przeżywa dynamiczny rozkwit. Uważana jest w większości za tanią, łatwo dostępną i bezpieczną. Należy do niej apiterapia – leczenie z wykorzystaniem surowców pszczelich (propolis, miód). Surowce te wytwarzane są przez pszczoły, które wykorzystują w tym celu różne rodzaje roślin, co niesie ryzyko, iż są one zanieczyszczone metalami ciężkimi, w tym rtęcią. Celem niniejszej pracy było określenie zawartości rtęci w różnych rodzajach miodów. Oszacowano ilość rtęci pobranej podczas spożycia badanych miodów.
Materiał i metody:
W badaniach wykorzystano 32 próbek miodów zebranych na terenie Polski w obrębie kilku województw: lubuskiego, małopolskiego, śląskiego, podkarpackiego i świętokrzyskiego. Były to różne rodzaje miodów. Z każdej próbki odważono łącznie 100 mg miodu i oznaczono zawartość rtęci z wykorzystaniem spektrometru absorpcji atomowej AMA 254.
Wyniki:
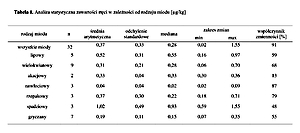
Badania wykazały, że rtęć była obecna we wszystkich próbkach poddanych analizie. Średnia zawartość rtęci w próbkach wynosiła 0,37 µg/kg. Największą ilość rtęci oznaczono w miodzie spadziowym – 1,55 µg/kg, a najmniejszą w miodzie nawłociowym – 0,02 µg/kg. Wyliczono dzienną dawkę rtęci dostarczaną z pożywieniem. W żadnym z przypadków nie została przekroczona wartość tolerowanego dziennego pobrania (TWI).
Wnioski:
W badanych próbkach miodów nie została przekroczona dopuszczalna zawartość rtęci. Ze względu na wciąż rosnące zanieczyszczenie środowiska konieczne jest dokładniejsze monitorowanie zawartości rtęci w miodach i innych produktach pszczelich, aby zapewnione było całkowite bezpieczeństwo spożywania ich przez ludzi.
Medycyna naturalna w obecnych czasach przeżywa dynamiczny rozkwit. Uważana jest w większości za tanią, łatwo dostępną i bezpieczną. Należy do niej apiterapia – leczenie z wykorzystaniem surowców pszczelich (propolis, miód). Surowce te wytwarzane są przez pszczoły, które wykorzystują w tym celu różne rodzaje roślin, co niesie ryzyko, iż są one zanieczyszczone metalami ciężkimi, w tym rtęcią. Celem niniejszej pracy było określenie zawartości rtęci w różnych rodzajach miodów. Oszacowano ilość rtęci pobranej podczas spożycia badanych miodów.
Materiał i metody:
W badaniach wykorzystano 32 próbek miodów zebranych na terenie Polski w obrębie kilku województw: lubuskiego, małopolskiego, śląskiego, podkarpackiego i świętokrzyskiego. Były to różne rodzaje miodów. Z każdej próbki odważono łącznie 100 mg miodu i oznaczono zawartość rtęci z wykorzystaniem spektrometru absorpcji atomowej AMA 254.
Wyniki:
Badania wykazały, że rtęć była obecna we wszystkich próbkach poddanych analizie. Średnia zawartość rtęci w próbkach wynosiła 0,37 µg/kg. Największą ilość rtęci oznaczono w miodzie spadziowym – 1,55 µg/kg, a najmniejszą w miodzie nawłociowym – 0,02 µg/kg. Wyliczono dzienną dawkę rtęci dostarczaną z pożywieniem. W żadnym z przypadków nie została przekroczona wartość tolerowanego dziennego pobrania (TWI).
Wnioski:
W badanych próbkach miodów nie została przekroczona dopuszczalna zawartość rtęci. Ze względu na wciąż rosnące zanieczyszczenie środowiska konieczne jest dokładniejsze monitorowanie zawartości rtęci w miodach i innych produktach pszczelich, aby zapewnione było całkowite bezpieczeństwo spożywania ich przez ludzi.
Introduction and objective:
At the present time, natural medicine is flourishing. This branch of medicine is generally considered as cheap, easily accessible and safe. Apitherapy is the type of natural medicine which uses honey bee products (propolis, honey), collected by bees from various types of plants. This is the reason why honey can be potentially contaminated by heavy metals, e.g. mercury. The aim of the study was evaluation of mercury content in various types of honey. The intake of Hg during the consumption of the examined types of honey was estimated.
Material and methods:
The study included 32 honey samples collected in several provinces in Poland: Zielona Góra, Kraków, Katowice, Rzeszów, and Kielce. These were different types of honey. From each sample 100 mg of honey was weighted and mercury content determined by atomic absorption spectrometer AMA 254.
Results:
The study confirmed the presence of mercury in all examined samples; mean value 0.32 µg/kg. The highest content of mercury was found in honeydew honey – 1.55 µg/kg, while the lowest in goldenrod honey – 0.02 µg/kg. The daily dose of mercury consumed with diet was calculated. The TWI value was not exceed in any of the samples.
Conclusions:
The allowable mercury content was not exceeded in the examined honey samples. Due to constantly increasing environmental pollution it is necessary to more thoroughly monitor the content of mercury in honey and other bee products, in order to ensure total safety of their consumption by humans.
At the present time, natural medicine is flourishing. This branch of medicine is generally considered as cheap, easily accessible and safe. Apitherapy is the type of natural medicine which uses honey bee products (propolis, honey), collected by bees from various types of plants. This is the reason why honey can be potentially contaminated by heavy metals, e.g. mercury. The aim of the study was evaluation of mercury content in various types of honey. The intake of Hg during the consumption of the examined types of honey was estimated.
Material and methods:
The study included 32 honey samples collected in several provinces in Poland: Zielona Góra, Kraków, Katowice, Rzeszów, and Kielce. These were different types of honey. From each sample 100 mg of honey was weighted and mercury content determined by atomic absorption spectrometer AMA 254.
Results:
The study confirmed the presence of mercury in all examined samples; mean value 0.32 µg/kg. The highest content of mercury was found in honeydew honey – 1.55 µg/kg, while the lowest in goldenrod honey – 0.02 µg/kg. The daily dose of mercury consumed with diet was calculated. The TWI value was not exceed in any of the samples.
Conclusions:
The allowable mercury content was not exceeded in the examined honey samples. Due to constantly increasing environmental pollution it is necessary to more thoroughly monitor the content of mercury in honey and other bee products, in order to ensure total safety of their consumption by humans.
REFERENCJE (27)
1.
Cyran M. Wpływ środowiskowego narażenia na rtęć na funkcjonowanie organizmu człowieka. Med Srod. 2013; 16(3): 55–58.
2.
Zhou F, Yin G, Gao Y, Liu D, Xie J, Ouyang L, Fan Y, Yu H, Zha Z, Wang K, Shao L, Feng Ch, Fan G. Toxicity assessment due to prenatal and lactational exposure to lead, cadmium and mercury mixtures. Environ Int. 2019; 133: 105192. doi: 10.1016/j.envint.2019.105192.
3.
Klassen CD, Watkins JB. Casarett and Doull Casarett & Doull's Essentials of toxicology, Third Edition. 2015 McGraw-Hill Education-Europe.
4.
Wang H, Chen B, He M, Yu X, Hu B. Selenocystine against methyl mercury cytotoxicity in HepG2 cells. Sci Rep. 2017; 7: 147.
5.
Takahashi T, Shimohata T. Vascular dysfunction induced by mercury exposure. Int J Mol Sci. 2019; 20(10): 2435. doi: 10.3390/ijms20102435.
6.
Rojas-Franco P, Franco-Colín M, Torres-Manzo AP, Blas-Valdivia V, Thompson-Bonilla MDR, Kandir S, Cano-Europa E. Endoplasmic reticulum stress participates in the pathophysiology of mercury-caused acute kidney injury. Ren Fail. 2019; 41(1): 1001–1010.
7.
Piontek M, Fedyczak Z, Łuszczyńska K, Lechów H. Toksyczność miedzi, cynku oraz kadmu, rtęci i ołowiu dla człowieka, kręgowców i organizmów wodnych. Zeszyty Naukowe. Inżynieria Środowiska / Uniwersytet Zielonogórski 2014; 155(35): 70–83.
8.
Yabana T, Sato K, Shiga Y, Himori N, Omodaka K, Nakazawa T. The relation ship between glutathione levels in leukocytes and ocular clinical parameters in glaucoma. PLoS One 2019; 14 (12): e0227078. doi: 10.1371/journal.pone.0227078.
9.
Nogueira LS, Vasconcelos CP, Mitre GP, da Silva Kataoka MS, Lima MO, de Oliveira EHC, Lima RR. Oxidative damage in Human Periodontal Ligament Fibroblast (hPLF) after methylmercury exposure. Longevity OMAC. 2019; 2019(7). doi: 10.1155/2019/8470857.
10.
Creed JH, Peeri NC, Anic GM, Thompson RC, Olson JJ, LaRocca RV, Chowdhary SA, Brockman JD, Gerke TA, Nabors LB, Egan KM. Methylmercury exposure, genetic variation in metabolic enzymes, and the risk of glioma. Sci Rep 2019; 9: 10861. doi: 10.1038/s41598-019-47284-4.
11.
Zhang W, Jiang X, Zhao S, Zheng X, Lan J, Wang H, Ng TB. A polysaccharide-peptide with mercury clearance activity from dried fruiting bodies of maitake mushroom Grifola frondosa. Sci Rep. 2018; 8(1): 17630. doi: 10.1038/s41598-018-35945-9.
12.
Lepretre G. Setting up an atomic absorption spectrometer (AAS) for determining heavy metals (Hg, Cd, Pb) in food. Master Analyse & Controle 2012, 38.
15.
Rozporządzenie komisji UE 2018/73 z dnia 16 stycznia 2018 r. zmieniające załączniki II i III do rozporządzenia (WE) nr 396/2005 Parlamentu Europejskiego i Rady w odniesieniu do najwyższych dopuszczalnych poziomów pozostałości związków rtęci w określonych produktach oraz na ich powierzchni.
16.
Madras-Majewska B, Jasiński Z. The content of mercury in bee bread originating from different region of Poland. J Apicultural Sci. 2005; 49: 69–73.
17.
Madras-Majewska B, Jasiński Z, Zajdel B, Gąbka J, Ochnio M, Petryka W, Kamiński Z, Ścięgosz J. Zawartość wybranych pierwiastków toksycznych w produktach pszczelich. Przegląd Hodowlany 2014; 82(3): 49–51.
18.
Dżugan M, Wesołowska M, Zaguła G, Kaczmarski M, Czernicka M, Puchalski C. Honeybees (Apis mellifera) as a biological barier for contamination of honey by environmental toxic metals. Environ Monit Assess. 2018; 190: 101. doi: 10.1007/s10661-018-6474-0.
19.
Quinto M, Miedico O, Spadaccino G, Paglia G, Mangiacotti M, Li D, Centonze D, Chiaravalle AE. Characterization, chemometric evaluation, and human health-related aspects of essential and toxic elements in Italian honey samples by inductively coupled plasma mass spectrometry. Environ Sci Pollut Res Int. 2016; 23(24): 25374–25384. doi: 10.1007/s11356-016-7662-5.
20.
Toth T, Kopernicka M, Sabo R, Kopernicka T. The evaluation of mercury in honey bees and their products from eastern Slovakia. Scientific Papers: Animal Science and Biotechnologies 2016; 49(1): 257–260.
21.
Maggid AD, Kimanya ME, Ndakidemi PA. The contamination and exposure of mercury in honey from Singida, Central Tanzania. Am J Res Comm. 2014; 2(10): 127–139.
22.
Toporcák J, Legáth J, Kul'ková J. Levels of mercury in samples of bees and honey from areas with and without industrial contamination. Vet Med (Praha) 1992; 37(7): 405–412.
23.
Akbari B, Gharanfoli F, Khayyat MH, Khashyarmanesh Z, Rezaee R, Karimi G. Determination of heavy metals in different honey brands from Iranian markets. Food Additives and Contaminants 2012; 5(2): 105–111.
24.
Maragou NC, Pavlidis G, Karasali H, Hatjina F. Cold vapor atomic absorption and microwave digestion for the determination of mercury in honey, pollen, propolis and bees of greek origin. Global NEST J. 2016; 18(4): 690–696.
25.
Ru QM, Feng Q, He JZ. Risk assessment of heavy metals in honey consumed in Zhejiang province, southeastern China. Food Chem Toxicol. 2013; 53: 256–262. doi: 10.1016/j.fct.2012.12.015.
26.
Bilandžić N, Dokić M, Sedak M, Kolanović BS, Varenina I, Končurat A, Rudan N. Determination of trace elements in Croatian floral honey originating from different regions. Food Chem. 2011; 128: 1160–1164.
27.
Lee HS, Cho YH, Park SO, Kye SH, Kim BH, Hahm TS, Kim M, Lee JO, Kim CI. Dietary exposure of the Korean population to arsenic, cadmium, lead and mercury. J Food Compos Anal. 2006; 19: 31–37.
Udostępnij
ARTYKUŁ POWIĄZANY
Przetwarzamy dane osobowe zbierane podczas odwiedzania serwisu. Realizacja funkcji pozyskiwania informacji o użytkownikach i ich zachowaniu odbywa się poprzez dobrowolnie wprowadzone w formularzach informacje oraz zapisywanie w urządzeniach końcowych plików cookies (tzw. ciasteczka). Dane, w tym pliki cookies, wykorzystywane są w celu realizacji usług, zapewnienia wygodnego korzystania ze strony oraz w celu monitorowania ruchu zgodnie z Polityką prywatności. Dane są także zbierane i przetwarzane przez narzędzie Google Analytics (więcej).
Możesz zmienić ustawienia cookies w swojej przeglądarce. Ograniczenie stosowania plików cookies w konfiguracji przeglądarki może wpłynąć na niektóre funkcjonalności dostępne na stronie.
Możesz zmienić ustawienia cookies w swojej przeglądarce. Ograniczenie stosowania plików cookies w konfiguracji przeglądarki może wpłynąć na niektóre funkcjonalności dostępne na stronie.